Мы так устроены: всегда надеемся на чудо-таблетки. Но часто методы, основанные на чём-то совсем простом, оказываются самыми эффективными. Причём даже при такой серьёзной болезни, как рак.
| Кстати | |
|---|---|
|
Как рассказали «АиФ» в ФГБУ «Российский научный центр рентгенорадиологии», в последние годы появился новый метод лечения злокачественных опухолей - онкотермия. Формально она относится к гипертермии. Но эффект - повреждение опухолевых клеток - достигается в основном за счёт локального воздействия слабого переменного высокочастотного электрического поля. И лишь на 30% за счёт повышения температуры. Исследования эффективности проводились более 20 лет в 30 клиниках стран Европы, СНГ, Азии и показали: онкотермия улучшает результаты лечения. Онкотермические установки есть в Москве, Новосибирске, Уфе, Ижевске, Нижнем Новгороде, Тамбове. Местная гипертермия используется также при лечении последних стадий рака вместе с химиотерапией для усиления противоопухолевого действия препаратов. Так, в МНИОИ им. Герцена внутрибрюшная гипертермия применяется при раке желудка, колоректальном раке и др. |
|
Около года назад «АиФ» () написал о необычной, но очень эффективной и безопасной методике профилактики рака и рецидивов опухолей, применяемой сибирскими учёными, - . Разработку уже перенимают клиники Германии и других стран Европы. Вот только отечественному здравоохранению она почему-то не нужна.
...и научили немцев
Что странно: наше государство, якобы жаждущее инноваций и научных разработок, создаёт целые наукограды, приглашая для этой цели даже иностранцев, и не замечает те, что уже, можно сказать, валяются под ногами. Бери да пользуйся. До сих пор метод общей пиковой гипертермии - до экстремальных температур - не включён Минздравом в реестр зарегистрированных лечебных технологий. И это несмотря на то, что наши учёные потратили 20 лет на разработки, испытали метод на животных, добровольцах, наконец, провели процедуру более 3,5 тыс. больных. И без единого осложнения! Почему же такой простой и недорогой (по сравнению с традиционным онкологическим лечением) метод не распространяют по отечественным клиникам?
Онкологические больные - самая ощутимая статья доходов для фармкомпаний. Международные корпорации создают всё новые химиопрепараты стоимостью в сотни тысяч долларов. Это миллионные прибыли ежегодно! Им выгоднее лечить, чем заниматься профилактикой рака.
Зато месяц назад бригаду врачей из Сибирского НИИ гипертермии пригласили в частную немецкую клинику Гизунт в г. Вильгельмсхафене обучить методике местных врачей. Руководитель клиники - профессор Венер, экс-президент Немецкого общества гипертермии, крупнейший в мире специалист в этой области. Наши врачи провели 9 процедур 5 больным и произвели огромное впечатление на немецких коллег.
После их отъезда немцы самостоятельно успешно провели ещё семь процедур. Теперь сибирских врачей ждут в Берлине в знаменитой клинике Шарите (в той, где рожала радистка Кэт), в Ахене, в Румынии, в Сербии. На очереди - открытие отделения в Варне.
«Мы открыты для всех, только Родине не нужны. Я не жалуюсь, просто жалко», - говорит профессор Алексей Сувернев, директор Сибирского НИИ гипертермии .
Страховка от рака
«АиФ» попросил Алексея Витальевича напомнить нашим читателям, в чём суть метода гипертермии: «Прогревание в медицине применяется более 45 лет. Однако известные до сих пор способы не позволяли нагреть тело пациента выше 42°С. Нам удалось сделать то, что считалось невозможным, - разработать способ выше 42-43°С без угрозы для жизни. Доказано: температура выше 41°С вызывает запрограммированную гибель раковых клеток (нормальные клетки переносят до 44-45°С).
Такую температуру в обычных условиях человек перенести не может. Поэтому процедура гипертермии проводится под наркозом, с применением искусственной вентиляции лёгких, когда аппаратура контролирует состояние всех жизненно важных органов. А перед тем как принять горячую ванну, пациент в течение суток проходит подготовку в стационаре, принимая специальные препараты, предотвращающие развитие теплового шока.
Гипертермия наилучшим образом помогает для профилактики рака и его рецидивов. Например, у человека после операции по поводу удаления злокачественной опухоли уровень онкомаркеров (белков раковых клеток) - 20, а через полгода - 40! Как убрать злокачественные клеточные колонии, которые не видны с помощью средств диагностики? Хирургия не годится - неизвестно, что отрезать. ? Неизвестно, что облучать.
Онкологи говорят: понаблюдаем. К сожалению, как бы блестяще ни была выполнена операция, уверенности в том, что метастазы не появятся, нет ни у одного пациента. Но можно ведь и не ждать, пока вырастет новая опухоль, а предотвратить её сверхвысоким прогреванием. После гипертермии онкомаркеры обнуляются. Можно предложить населению такую страховку от рака - раз в год проходить теплолечение. Хотя надо понимать: при больших опухолях оно уже не поможет и даже опасно.
Гипертермия оздоравливает весь организм: замедляется старение, улучшаются репродуктивные функции, повышается либидо. Намечается также перспектива эффективного лечения таких «трудных» заболеваний, как герпес, хламидиоз, гепатиты С и В, сифилис, ВИЧ. Уже при 42°С половина всей армии вредоносных вирусов и микробов уничтожается».
- и немелкоклеточный рак легкого. Эти типы диагностируются на основе того, как клетки выглядят под микроскопом. Исходя из установленного типа, выбираются варианты лечения. Для понимания прогнозов заболевания и выживаемости представляю статистику из открытых источников США на 2014 год по обоим типам рака легких вместе: Новые случаи заболевания (прогноз : 224210 Количество прогнозируемых смертей: 159260 Рассмотрим подробно оба типа, специфику и варианты лечения.">Рак легких 4
- в США в 2014 году: Новые случаи: 232670. Смертей: 40000. Рак молочной железы является наиболее распространенным не кожным раком среди женщин в США (открытые источники, по оценкам, в США в 2014 году предвидится 62 570 случаев прединвазивных заболеваний (in situ, 232670 новых случаев инвазивного заболевания, и 40 000 смертей. Таким образом, менее чем одна из шести женщин с диагнозом рак молочной железы умирает от болезни. Для сравнения, по оценкам, около 72 330 американских женщин умрут от рака легких в 2014 году. Рак молочной железы у мужчин (да, да, есть такое составляет 1% всех случаев рака молочной железы и смертности от этой болезни. Широкое распространение скрининга повысило заболеваемость раком молочной железы и изменило характеристики обнаруживаемого рака. Почему повысило? Да потому, что использование современных методов позволило обнаруживать заболеваемость раком низкого риска, предраковых поражений и рака протоков in situ (DCIS. Популяционные исследования, проведенные в США и Великобритании, показывают увеличение DCIS и заболеваемость инвазивным раком молочной железы с 1970 года, это связано с широким распространением гормональной терапии в постменопаузе и маммографии. В последнее десятилетие, женщины воздерживаются от использования в постменопаузе гормонов и частота рака молочной железы снизилась, но не до уровня, которого можно достичь при широком использовании маммографии. Факторы риска и защиты Увеличение возраста является наиболее важным фактором риска для рака молочной железы. Другие факторы риска для рака молочной железы включают в себя следующее: Семейная история болезни o Основная наследственная восприимчивость Половые мутации генов BRCA1 и BRCA2, и других генов восприимчивости рака молочной железы Потребление алкоголя Плотность ткани груди (маммографическая Эстроген (эндогенный: o Менструальная история (начало менструации / поздняя менопауза o Отсутствие родов в анамнезе o Пожилой возраст при рождении первого ребенка История гормональной терапии: o Комбинация эстрогена и прогестина (HRT Оральная контрацепция Ожирение Отсутствие физических упражнений Личная история рака молочной железы Личная история пролиферативных форм доброкачественных заболеваний молочной железы Радиационное облучение груди Из всех женщин с раком молочной железы, от 5% до 10% может иметь зародышевые линии мутации генов BRCA1 и BRCA2. В ходе исследований выяснилось, что специфические мутации BRCA1 и BRCA2 более распространены среди женщин еврейского происхождения. Мужчины, которые являются носителями мутации BRCA2 также имеют повышенный риск развития рака молочной железы. Мутации как в гене BRCA1, так и в BRCA2, также создают повышенный риск развития рака яичников или других первичных раковых заболеваний. После того, как мутации BRCA1 или BRCA2 были идентифицированы, желательно, чтобы другие члены семьи попали на генетическое консультирование и тестирование. Защитные факторы и меры по снижению риска развития рака молочной железы включают в себя следующее: Использование эстрогена (особенно после гистерэктомии Создание привычки к выполнению физических упражнений Ранняя беременность Грудное вскармливание Селективные модуляторы рецептора эстрогена (СМРЭ Ингибиторы ароматазы или инактиваторы Снижение рисков мастэктомии Снижение риска овариэктомии или удаления яичников Скрининг Клинические испытания установили, что скрининг бессимптомных женщин с помощью маммографии, с или без клинического обследования молочной железы, снижает смертность от рака молочной железы. Диагностика В случае, если подозревается рак молочной железы, пациентка обычно должна пройти следующие этапы: Подтверждение диагноза. Оценка стадии заболевания. Выбор терапии. Следующие тесты и процедуры используются для диагностики рака молочной железы: Маммография. Ультразвук. Магнитно-резонансная томография груди (МРТ, при наличии клинических показаний. Биопсия. Контралатеральный рак молочной железы Патологически, рак молочной железы может быть многоцентровым и двусторонним поражением. Двустороннее заболевание несколько чаще встречается у пациенток с проникновением очаговой карциномы. За 10 лет после постановки диагноза, риск первичного рака молочной железы в контралатеральной молочной железе в пределах от 3% до 10%, хотя эндокринная терапия может уменьшить этот риск. Развитие рака второй молочной железы связано с повышенным риском отдаленного рецидива. В случае, когда мутация генов BRCA1 / BRCA2 была диагностирована в возрасте до 40 лет, риск рака второй молочной железы в последующие 25 лет достигает почти 50%. Пациенткам, у которых диагностирован рак молочной железы необходимо пройти двустороннюю маммографию на момент постановки диагноза, чтобы исключить синхронное заболевание. Роль МРТ в скрининге контралатерального рака груди и мониторинг женщин, получавших терапию грудного сохранения, продолжает развиваться. Поскольку повышенный уровень обнаружения при маммографии возможной болезни была продемонстрирована, избирательное применение МРТ для дополнительного скрининга происходит чаще, несмотря на отсутствие рандомизированных контролируемых данных. Поскольку только 25% МРТ-положительных выводов представляют злокачественности, рекомендуется патологическое подтверждение до начала лечения. Приведет ли это увеличение скорости обнаружения болезни к улучшению результатов лечения неизвестно. Прогностические факторы Рак молочной железы обычно лечится с помощью различных комбинаций хирургии, лучевой терапии, химиотерапии и гормональной терапии. Выводы и подбор терапии может быть под влиянием следующих клинических и патологических особенностей (на основе обычной гистологии и иммуногистохимии: Климактерический статус пациентки. Стадия заболевания. Степень первичной опухоли. Статус опухоли в зависимости от состояния рецепторов эстрогена (ER и рецепторов прогестерона (PR. Гистологические типы. Рак молочной железы классифицируется на различные гистологические типы, некоторые из которых имеют прогностическое значение. Например, благоприятные гистологические типы включают коллоидный, медуллярный и трубчатый рак. Использование молекулярного профилирования при раке молочной железы включает в себя следующее: ER и тестирование статуса PR. Тестирование рецепторного статуса HER2 / Neu. На основании этих результатов, рак молочной железы классифицируется как: Гормон-рецепторный положительный. Положительный HER2. Тройной негативный (ER, PR и HER2 / Neu отрицательный. Хотя некоторые редкие наследственные мутации, такие как BRCA1 и BRCA2, предрасполагают к развитию рака молочной у носительниц мутации, однако прогностические данные о носителях мутации BRCA1 /BRCA2 являются противоречивыми; эти женщины просто подвергаются большему риску развития рака второй молочной железы. Но не факт, что это может произойти. Заместительная гормональная терапия После тщательного рассмотрения, пациентки с тяжелыми симптомами могут быть обработаны заместительной гормональной терапии. Последующий контроль Частота наблюдения и целесообразность скрининга после завершения первичного лечения стадии I, II стадии, или стадии III рака молочной железы остаются спорными. Данные из рандомизированных исследований показывают, что периодическое наблюдение со сканированием костей, УЗИ печени, рентгенографии грудной клетки и анализами крови для функций печени вовсе не улучшает выживаемость и качество жизни по сравнению с обычными медосмотрами. Даже когда эти тесты позволяют сделать раннее выявление рецидива заболевания, на выживаемость больных это не влияет. На основе этих данных, приемлемым продолжением может быть ограниченные осмотры и ежегодная маммография для бессимптомных пациентов, которые прошли лечение на стадиях от I до III рака молочной железы. Более подробная информация в статьях: ">Рак молочной железы 5
- , мочеточники, и ближняя уретра облицованы специализированной слизистой оболочкой, называемой переходным эпителием (также называемый уротелий . Большинство раковых заболеваний, которые формируются в мочевом пузыре, почечном тазу, мочеточниках, и ближней уретре переходные клеточные карциномы (также называемые уротелиальные карциномы , производные от переходного эпителия. Переходно-клеточный рака мочевого пузыря может быть низкой степени злокачественности или полноценный: Рак мочевого пузыря низкой злокачественности часто рецидивирует в мочевом пузыре после лечения, но редко вторгается в мышечные стенки мочевого пузыря или распространяется на другие части тела. Пациенты редко умирают от рака мочевого пузыря низкой злокачественности. Полноценный рак мочевого пузыря обычно повторяется в пузыре, а также имеет сильную тенденцию вторгаться в мышечные стенки мочевого пузыря и распространятся на другие части тела. Рак мочевого пузыря с высокой злокачественностью рассматривается как более агрессивный, чем рак мочевого пузыря с низкой злокачественностью и гораздо более вероятно, приведет к смерти. Почти все смерти от рака мочевого пузыря являются следствием рака с высокой злокачественностью. Рак мочевого пузыря также разделен на мышечно-инвазивное и немышечно-инвазивное заболевание, основываясь на вторжение в слизистую мышц (также упоминается как детрузора , которая располагается глубоко в мышечной стенке мочевого пузыря. Мышечно-инвазивное заболевания гораздо более вероятно, распространится и на другие части тела и, как правило, лечится либо удалением мочевого пузыря или лечением мочевого пузыря с помощью лучевой и химиотерапии. Как было отмечено выше, рак с высокой степенью злокачественности имеет гораздо больше шансов быть мышечно-инвазивным раком, чем рак с низкой степенью злокачественности. Таким образом, мышечно-инвазивный рак, как правило, рассматривается как более агрессивный, чем немышечно-инвазивный рак. Немышечно-инвазивную болезнь часто можно лечить путем удаления опухоли с помощью трансуретрального подхода, а иногда и химиотерапии или других процедур, при которых лекарственное средство вводят в полость мочевого пузыря с помощью катетера, чтобы помочь бороться с раком. Рак может возникнуть в мочевом пузыре в условиях хронического воспаления, такого как инфекция мочевого пузыря, вызванная паразитом haematobium Schistosoma, или в результате плоскоклеточной метаплазии; Частота плоскоклеточного рака мочевого пузыря выше в условиях хронического воспаления, чем в противном случае. В дополнение к переходной карциноме и плоскоклеточному раку, в мочевом пузыре могут образовываться аденокарцинома, мелкоклеточный рак и саркома. В Соединенных Штатах, переходные клеточные карциномы составляют подавляющее большинство (более 90% рака мочевого пузыря. Тем не менее, значительное количество переходных карцином имеют участки плоскоклеточной или другой дифференциации. Канцерогенез и факторы риска Существуют убедительные доказательства воздействия канцерогенов на возникновение и развитие рака мочевого пузыря. Наиболее распространенным фактором риска развития рака мочевого пузыря в является курение сигарет. По оценкам, до половины всех случаев рака мочевого пузыря вызваны курением и, что курение увеличивает риск развития рака мочевого пузыря у в два-четыре раза выше исходного риска. Курильщики с менее функциональным полиморфизмом N-ацетилтрансферазы-2 (известные как медленный ацетилятор имеют более высокий риск развития рака мочевого пузыря по сравнению с другими курильщиками, по-видимому, в связи со снижением способности к детоксикации канцерогенов. Некоторые профессиональные вредности, также были связаны с раком мочевого пузыря, и более высокие темпы развития рака мочевого пузыря были зарегистрированы из-за текстильных красителей и каучука в шинной промышленности; среди художников; рабочих кожеперерабатывающих производств; у сапожников; и алюминий-, железо-и сталеваров. Конкретные химические вещества, связанные с канцерогенезом мочевого пузыря включают бета-нафтиламин, 4-аминобифенил и бензидин. Хотя эти химические вещества в настоящее время в целом запрещены в западных странах, многие другие химические вещества, которые до сих пор используются также подозреваются в инициации рака мочевого пузыря. Воздействие химиотерапевтического агента циклофосфамид также оказалось связанным с повышенным риском развития рака мочевого пузыря. Хронические инфекции мочевыводящих путей и инфекции, возникающие под воздействием паразита S. haematobium также связаны с повышенным риском развития рака мочевого пузыря, и часто плоскоклеточного рака. Хроническое воспаление, как полагают, играет ключевую роль в процессе канцерогенеза в этих условиях. Клинические признаки Рак мочевого пузыря обычно проявляется простой или микроскопической гематурией. Реже пациенты могут жаловаться на учащенное мочеиспускание, никтурия, и дизурия, симптомы, которые чаще встречаются у пациентов с карциномой. Пациенты с уротелиальным раком верхних мочевых путей могут ощущать боли вследствие обструкции опухолью. Важно отметить, что уротелиальная карцинома часто мультифокальна, что вызывает необходимость проверки всего уротелия в случае обнаружения опухоли. У пациентов с раком мочевого пузыря, визуализация верхних мочевых путей имеет важное значение для постановки диагноза и наблюдения. Это может быть достигнуто с помощью уретроскопии, ретроградной пиелограммы в цистоскопии, внутривенной пиелограммы, или компьютерной томографии (КТ урограммы. Кроме того, пациенты с переходно-клеточным раком верхних мочевых путей имеют высокий риск развития рака мочевого пузыря; эти пациенты нуждаются в периодической цистоскопии и наблюдении за противоположными верхними мочевыми путями. Диагностика Когда подозревается рак мочевого пузыря, самым полезным диагностическим тестом является цистоскопия. Радиологическое исследование, такое как компьютерная томография или УЗИ не имеют достаточной чувствительности, чтобы быть полезным для обнаружения рака мочевого пузыря. Цистоскопия может быть выполнена в урологической клинике. Если в процессе цистоскопии обнаружен рак, пациент, как правило, планируется на бимануальное исследования под наркозом и повторную цистоскопию в операционной комнате, так чтобы могли быть выполнены трансуретральная резекция опухоли и / или биопсия. Выживание У пациентов, которые умирают от рака мочевого пузыря, почти всегда есть метастазы из мочевого пузыря в другие органы. Рак мочевого пузыря с низким уровнем злокачественности редко вырастает в мышечную стенку мочевого пузыря и редко метастазирует, поэтому пациенты с малым уровнем злокачественности (стадия I рака мочевого пузыря очень редко умирают от рака. Тем не менее, они могут испытывать многократные рецидивы, которые должны быть подвергнуты резекции. Почти все смерти от рака мочевого пузыря происходят среди пациентов с болезнью с высоким уровнем злокачественности, который имеет гораздо больший потенциал для вторжения глубоко в мышечные стенки мочевого пузыря и распространения в другие органы. Примерно 70% до 80% пациентов с впервые выявленным раком мочевого пузыря имеют поверхностные опухоли мочевого пузыря (т.е. стадии Та, TIS, или T1 . Прогноз этих больных во многом зависит от степени опухоли. Пациенты с опухолями высокой степени злокачественности имеют значительный риск умереть от рака, даже если это не мышце-инвазивный рак. Те пациенты с опухолями высокой степени злокачественности, у кого диагностирован поверхностный, немышечно-инвазивный рак мочевого пузыря в большинстве случаев имеют высокие шансы на излечение, и даже при наличии мышечно-инвазивного заболевания иногда пациента можно вылечить. Исследования показали, что у некоторых пациентов с отдаленными метастазами онкологи добились долгосрочного полного ответа после лечения по схеме комбинированной химиотерапии, хотя у большинство таких пациентов метастазы ограничиваются их лимфатическими узлами. Вторичный рак мочевого пузыря Рак мочевого пузыря, как правило, повторяется, даже если он является неинвазивным на момент постановки диагноза. Поэтому стандартная практика заключается в проведении наблюдения за мочевыводящими путями после постановки диагноза рака мочевого пузыря. Однако еще не было проведено исследований, чтобы оценить, влияет ли наблюдение на темпы прогрессирования, выживаемость, или качество жизни; хотя есть клинические испытания по определению оптимального графика наблюдения. Уротелиальная карцинома, как полагают, отражает так называемый полевой дефект при котором рак возникает благодаря генетическим мутациям, которые широко представлены в мочевом пузыре пациента или во всей уротелии. Таким образом, люди, которые имели резецированную опухоль мочевого пузыря часто впоследствии имеют текущие опухоли в мочевом пузыре, часто в других местах в отличии от первичной опухоли. Точно так же, но реже, у них могут появляться опухоли в верхних мочевых путях (т.е., в почечных лоханках или мочеточниках . Альтернативное объяснение этих моделей рецидива является то, что раковые клетки, которые разрушаются при иссечении опухоли, могут реимплантироваться в другом месте в уротелии. Поддержка этой второй теории, что опухоли, скорее всего, повторяются ниже, чем в обратном направлении от начального рака. Рак верхних мочевых путей, скорее всего, повторится в мочевом пузыре, чем рак мочевого пузыря будет воспроизведен в верхних мочевых путях. Остальное в следующих статьях: ">Рак мочевого пузыря 4
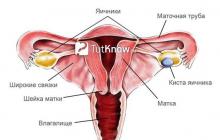
- , а также повышенный риск метастатического поражения. Степень дифференцировки (определения стадии развития опухоли имеет важное влияние на естественную историю этой болезни и на выбор лечения. Увеличение случаев рака эндометрия было обнаружено в связи с длительным, не встречающим сопротивления воздействием эстрогена (повышенный уровень . В отличие от этого, комбинированная терапия (эстроген + прогестерон предотвращает увеличение риска развития рака эндометрия, связанного с отсутствием сопротивления воздействию конкретно эстрогена. Получение диагноза не самый удачный момент. Однако вы должны знать - рак эндометрия относится к излечимым заболеваниям. Следите за симптомами и все будет хорошо! У некоторых больных, может сыграть роль “активатора” рака эндометрия предшествующая история сложной гиперплазии с атипией. Увеличение числа случаев рака эндометрия также было обнаружено в связи с лечением рака молочной железы тамоксифеном. По мнению исследователей это связано с эстрогенным эффектом тамоксифена на эндометрий. Из-за этого увеличения, пациентки, которым назначена терапия с применением тамоксифена должны в обязательном порядке регулярно проходить обследования тазовой области и должны внимательно относиться к любым патологическим маточным кровотечениям. Гистопатология Характер распространения злокачественных клеток рака эндометрия частично зависит от степени клеточной дифференцировки. Хорошо дифференцированные опухоли, как правило, ограничивают их распространение на поверхности слизистой оболочки матки; реже происходит миометриальное расширение. У больных с плохо дифференцированной опухолью, вторжение в миометрий встречается значительно чаще. Вторжение в миометрий часто является предвестником поражения лимфатических узлов и отдаленных метастазов, и часто зависит от степени дифференциации. Метастазирование происходит обычным образом. Распространение в тазовые и парааортальные узлы является распространенным явлением. При возникновении отдаленных метастазов, это наиболее часто происходит в: Легкие. Паховые и надключичные узлы. Печень. Кости. Мозг. Влагалище. Прогностические факторы Еще одним фактором, который связан с внематочным и узловым распространением опухоли является участие капиллярно-лимфатического пространства в гистологическом обследовании. Три прогностические группировки клинической стадии I стали возможными благодаря тщательной оперативной постановке. Пациенты с опухолью в стадии 1, включающие только эндометрий и не имеющие признаков внутрибрюшинного заболевания (то есть распространения на придатки имеют низкий риск (">Рак эндометрия 4
Хирургия, радиация и химиотерапия - все это хорошо известные и хорошо зарекомендовавшие себя методы лечения рака кожи. Другое лечение, которое в настоящее время исследуется, использует тепло для уничтожения меланомы и других типов раковых клеток. Это называется гипертермией.
Гипертермия использует контролируемый уровень тепла - от 104 до 111 ° F - для лечения меланомы и других видов рака. Этот температурный диапазон приводит к изменениям в раковых клетках, которые либо непосредственно заставляют их умирать, либо сделать их более уязвимыми к последствиям стандартных методов лечения рака, таких как радиация и химиотерапия. Преимущество гипертермии заключается в том, что она менее подвержена повреждению здоровых клеток.
Исследования показывают, что доставка тепла опухолям может помочь уменьшить их. Врачи часто дают гипертермию до лучевой терапии или химиотерапии для повышения эффективности этих методов лечения.
Как дается гипертермия?
Тепло подается в опухоль, орган или область тела из источника энергии, такого как радиочастота, микроволновая печь или ультразвук. Врачи используют три разных метода гипертермии для лечения рака:
Местная гипертермия
Местная гипертермия поставляет тепло непосредственно в опухоль . Когда рак находится на поверхности кожи или находится чуть ниже ее поверхности, тепло подается снаружи тела. Для опухолей, глубже внутри тела, для подачи тепла вставлен зонд или игла.
Радиочастотная абляция (RFA) является одним из видов местной гипертермии. Он использует волны высокой энергии для нагрева опухоли. Ультразвук, компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) помогают вести врачу к опухоли. Зонд высвобождает энергию в опухоль в течение 30 минут для уничтожения раковых клеток. Мертвые клетки в конечном итоге превращаются в рубцовую ткань и сжимаются. RFA обычно используется для лечения рака внутри органов, таких как печень или легкие, но это может быть вариант для распространения меланомы.
Региональная гипертермия
Региональная гипертермия нагревает большие области тела, такие как орган, рука или нога. Один тип региональной гипертермии, называемый региональной перфузией или перфузией изоляции, тестируется на меланому в руке или ноге. Чтобы выполнить эту технику, врачи сначала отделяют кровоснабжение от этой конечности. Затем они используют машину для нагрева крови, прежде чем доставить ее обратно в эту область. Это лечение может использоваться вместе с химиотерапией.
Гипертермия всего тела
Гипертермия всего тела используется для лечения таких раков, как меланома, которые распространились (метастатический рак). Врачи используют нагретые одеяла, теплую воду или машины, называемые тепловыми камерами, для повышения температуры тела пациента. Считается, что тепло стимулирует иммунную систему для борьбы с раком. Нагревание всего тела сразу же помогает химиотерапии работать более эффективно.
Температура, используемая при гипертермии всего тела, отличается от исследования к исследованию. Некоторые исследователи нагревают своих пациентов до температуры от 107 до 108 ° F.
Каковы побочные эффекты и риски?
Пока температура остается ниже 111 ° F, она не должна повреждать здоровые ткани. Однако гипертермия может создавать горячие точки, которые намного теплее. Эти всплески тепла могут вызывать болезненные ожоги и волдыри на коже и внутри тела. Кроме того, некоторые области тела, подобно мозгу, более чувствительны к воздействию тепла, чем другие. Врачи стараются поддерживать уровень тепла в области обработки, используя термометры для постоянного контроля температуры.
Другие возможные побочные эффекты зависят от того, какой тип лечения гипертермии у вас есть.
Побочные эффекты от локальной гипертермии включают:
- инфекция
- набухание
- кровотечение
- сгустки крови
- повреждение кожи, мышц и нервов в области лечения
Side эффекты от региональной и всей гипертермии включают:
- тошнота
- рвота
- диарея
- проблемы с сердцем
- повреждение кровеносных сосудов
У вас могут также быть побочные эффекты от химиотерапии или радиации, если вы получили эти одновременно с гипертермией.
Где я могу получить гипертермию?
В настоящее время гипертермия доступна только в клинических испытаниях в специализированных онкологических центрах. Только врачи, прошедшие специальную подготовку по методам гипертермии, могут безопасно доставить это лечение.
Результаты исследований гипертермии до сих пор были многообещающими. Тем не менее, исследователи все еще нуждаются в дополнительных доказательствах, подтверждающих, что они безопасны и эффективны против рака.
Если вы заинтересованы в участии в клинических испытаниях гипертермии, спросите своего онколога о том, доступно ли исследование вашего типа рака в вашем районе.
Выбор редакции

Профессионал здравоохранения
Обзор Киста в почках - это наполненный жидкостью мешок, который растет в ваших почках, которые являются фасолированными органами, которые фильтруют отходы из вашего кровотока для получения мочи. У вас может быть одна киста на одной почке или много кист на обеих почках. Существует два типа кист: простые кисты и поликистозная болезнь почек.
Гипертермия теперь включена в Руководство по клинической практике NCCN для лечения рецидивов рака молочной железы. Доктор Аркадий Бессантин (Израиль, Тель-Авив) успешно использует эту современную методику при лечении пациентов с раком груди.
Цель этого обзора — представить проведенные в последние десятилетия клинические испытания применения гипертермии в сочетании с лучевой терапией и / или химиотерапией для лечения рака молочной железы. Данная статья подробно освещает основные принципы NCCN, которые теперь включают применение гипертермии для клинического лечения рецидивирующих поражений кожи при раке молочной железы, поддерживая потенциальную положительную роль гипертермии в локальном контроле за рецидивами опухоли.
Гипертермия - перегревание, накопление избыточного тепла в организме человека и животных с повышением температуры тела, вызванное внешними факторами, затрудняющими теплоотдачу во внешнюю среду или увеличивающими поступление тепла извне. (Википедия)
Введение
Является одним из наиболее распространенных видов рака и представляет собой серьезную проблему, поскольку каждый год число случаев заболевания этим недугом увеличивается. Хотя в настоящее время возможно раннее выявление рака молочной железы, у 30% пациентов на ранней стадии заболевания вероятней всего последуют дальнейшие рецидивы. Лечение пациентов с локально распространенным раком молочной железы состоит из химиотерапии, сопровождаемой радикальной мастэктомией (это операция, связанная с полной или частичной ампутацией груди) и лучевой терапией, а в некоторых случаях и гормональной терапией. Несмотря на то, что эта комбинированная терапия — пока оптимальный выбор с точки зрения местного контроля над опухолью, для лучшего клинического результата все еще необходимо подбирать новые методы лечения.
В соответствии с принципами Национальной антиоксидантной сети 2013 года (NCCN) гипертермия включена в клиническую практику для лечения рецидивов рака молочной железы. Целью гипертермии является повышение температуры опухоли до 42-45 ° C. Существуют различные методы применения гипертермии в зависимости от расположения опухоли. Для опухолей с глубиной менее 5 см при раке молочной железы, в основном используется поверхностная гипертермия. Поверхностная гипертермия в сочетании с лучевой терапией и / или химиотерапией оказалась эффективней, чем отдельно лучевая терапия или химиотерапия, так как механизмы действия лучевой терапии и гипертермии дополняют друг друга. Кроме того, правильное клиническое применение гипертермии имеет большое значение, поскольку термические параметры, такие как минимальная или максимальная температура опухоли во время термотерапии, влияют на клинический результат лечения.
Все испытания, включенные в этот обзор, были получены из Medline (сокращение от MEDlars onLINE MEDLARS (MEDical Literature Analysis and Retrieval System) — самая крупная база данных опубликованной медицинской информации в мире, которая охватывает около 75 процентов всех мировых изданий.) и были опубликованы с 1987 года по настоящее время.
Данные испытания демонстрируют, как гипертермия в сочетании с лучевой терапией и / или химиотерапией влияет на пациентов, страдающих раком молочной железы, и изучают преимущества этого комбинированного лечения. Данные, полученные в каждом исследовании, показывают количество пациентов с первичным заболеванием или с рецидивом рака молочной железы и терапевтические методы, используемые для их лечения. Основными оцениваемыми параметрами являются скорость ответа на терапию, полные и частичные коэффициенты ответа, местный контроль за опухолью и показатели выживаемости. Наконец, рассматривается токсичность, вызванная гипертермией.
Результаты и обсуждение

Первые клинические результаты сравнительных исследований терморадиотерапии (RTHT) по сравнению с лучевой терапией при поверхностных опухолях были опубликованы до 1990 года. В 1987 году были опубликованы результаты исследования, в котором пациенты с поверхностными рецидивирующими злокачественными опухолями получали низкую дозу лучевой терапии с локальной гипертермией или без нее (915 или 2450 МГц). Большинство опухолей (53%) являлись аденокарциномой молочной железы. Полная, а также частичная частота ответа на лечение была выше в группе комбинированной терапии, что свидетельствует о том, что гипертермия в сочетании с низкой дозой излучения может быть полезна при лечении поверхностных рецидивов опухоли, особенно в случаях, когда более высокие дозы лучевой терапии применялись ранее. При лечении токсичность воздействия 3-го класса (десквамация (т.е. слущивание клеток с поверхности) с пузырьками / влажная десквамация) была соответственно 21,2 и 4,2%, токсичность 4-го класса (малый некроз (отмирание) или изъязвление / массивное изъязвление) 24,2 и 8,3% соответственно. Некроз подкожной жировой ткани (4 степень) был зарегистрирован у 3 пациентов и 1 пациента соответственно.
Было проведено исследование, которое также доказало эффективность комбинированного лечения: 35 пациентов с рецидивами карциномы молочной железы получали гипертермию в дополнение к лучевой терапии, которая проводилась в течение 30 мин после облучения. Сравнение между 9 пациентами, которые получили только лучевую терапию и 9 пациентами, которые получали РТТ, показало, что частота ответа на лечение составила 33,3% (3/9) и 77,7% (7/9) соответственно. Гипертермия переносилась организмом без серьезных осложнений.
Группой по радиационной онко-терапии (RTOG), для оценки гипертермии лечения поверхностных опухолей (включая рак молочной железы), в рандомизированном исследовании была установлена корреляция (взаимозависимость) между диаметром опухоли и частотой ответа: результаты исследования показали улучшение ответа, особенно при поражениях диаметром менее 3 см, получивших более 2 гипертермических процедур (42,5 ° C). Частота поддержания стойкого ответа в течение 12 месяцев была выше у пациентов, получавших РТНТ, чем у тех, кто получал только лучевую терапию. Эти данные показывают, что добавление гипертермии дает более длительный и полный ответ на лечение.
Гипертермия в сочетании с лучевой терапией для прогрессирующей или локально рецидивирующей карциномы молочной железы: исследования были проведены у 40 пациентов (10 первичных случаев заболевания и 30 рецидивов). Было решено, что пациенты с меньшими поражениями получат только лучевую терапию, а пациенты с большими поражениями получат РТТ. Опухоли, в отношении которых применялась гипертермия, лучше ответили на терапию, чем новообразования, которые получали лишь лучевую терапию.Также сообщалось, что пациенты с первичными опухолями, которые получали облучение, имели низкий уровень полного и частичного ответа и местного контроля над опухолью, тогда как эти показатели увеличивались с добавлением гипертермии. При рецидивирующих опухолях после операции, частота локального ответа на лечение после лучевой терапии также увеличивалась с добавлением гипертермии. Был сделан вывод о том, что комбинированное лечение дает улучшенный клинический результат у пациентов, страдающих локальным первичным и рецидивирующим раком молочной железы.В исследованиях также отмечено, что имеет значение и размер опухоли. Гипертермия в поверхностных опухолях более эффективна, когда диаметр поражения составляет менее 3 см.
Одно из крупнейших исследований для оценки эффективности гипертермии было опубликовано в 1996 году: всего в этот анализ было включено 306 поражений. Результаты были получены в результате 5 разных рандомизированных исследований в области лечения рака молочной железы с RTHT (фаза III).Исследования доказали, что гипертермия дает преимущество при добавлении к лучевой терапии в основном при рецидивирующем раке молочной железы, где из-за предыдущей лучевой терапии рекомендовано использовать более низкие дозы облучения. Общий полный коэффициент ответа на лечение составлял 59% для RTHT и 41% для лучевой терапии.
Исследование для определения взаимосвязи между тепловыми параметрами гипертермии и результатом лечения у пациентов, страдающих рецидивирующим раком груди: было проведено сравнение ответа на лечение у пациентов, которые получали РТТТ и у пациентов, которые получали только лучевую терапию. Общий коэффициент ответа составил 61 и 41% соответственно. В рандомизированном исследовании оценивали роль тепловой дозы при лечении поверхностных поражений, включая рак молочной железы. Исследователей интересовал ответ на лечение и продолжительность местного контроля. Пациенты были разделены на 2 группы. Первую группу лечили только лучевой терапией, а вторую группу — РТТ. Полный коэффициент ответа на терапию и местный контрольный показатель улучшились с добавлением гипертермии. Наибольшее улучшение местного контроля наблюдалось у пациентов, которые уже получали лучевую терапию при предыдущем лечении.
Исследование 2008 года : это исследование включало пациентов из 8 различных медицинских учреждений. У всех них была рецидивирующая карцинома молочной железы и все они получали повторное облучение молочной железы после локального рецидива. Часть пациентов получала гипотермию в дополнение к лучевой терапии. Полная частота ответа на лечение составила 67% — с применением гипотермии и 39% — без нее.
Проверка эффективности гипертермии, как паллиативного лечения локально рекуррентной карциномы молочной железы: 30 пациентов с раком молочной железы после лечения другими традиционными методами, получили низкую дозу облучения + 1 час гипертермии. Результаты подтвердили влияние гипертермии на уменьшение рецидивов рака молочной железы. Кроме того, поражения с диаметром менее 5 см лучше отвечали на комбинированное лечение.
Доказано, что RTHT обеспечивает улучшение местного контроля за опухолью при лечении рецидивирующего рака молочной железы: 34 пациента получили РТТ, у 4 пациентов была химиотерапия в комплексе с гипертермией, а у 4 пациентов была только гипертермия. Было отмечено, что только те пациенты, которые получили РТТТ, полностью ответили на терапию и показали улучшение местного контроля над заболеваниями.44 пациента, страдающие локально рекуррентной аденокарциномой молочной железы, получали RTHT. Частоту ответов на лечение анализировали через 1 месяц после завершения терапии. Через 12 месяцев 67% пациентов, которые достигли полного ответа, все еще сохраняли положительную динамику. Было обнаружено, что размер опухоли значительно влияет на клинический результат.
Применение гипертермии в сочетании с лучевой терапией для лечения рецидивов карциномы молочной железы с метастазами: Чтобы оценить результативность лечения, провели исследование с участием 20 пациентов. Большинство пациентов (95%) полностью ответили на комбинированное лечение, которое было эффективным в случае обширных диффузных повреждений при раке молочной железы. Однако средняя выживаемость этих пациентов была неудовлетворительной из-за наличия метастаз вне обработанных областей.
Применение поверхностного RTHT у пациентов с рецидивирующей карциномой груди: Во время максимальной регрессии полная частота ответа составляла 63%. Выживаемость через 2,5 года составила 21%, а через 5 лет — 8%. В Нидерландах RTHT является стандартным методом лечения ранее облученных пациентов, у которых случился рецидив рака молочной железы. Исследования показали, что одновременное применение гипертермии и облучения дает лучший клинический результат, чем последовательное применение. Этот метод применили у пациентов с поверхностными опухолями. Рассматривались преимущественно случаи онкологических заболеваний головы и шеи, а также аденокарцинома груди. Реакция на терапию при аденокарциноме груди была такова: полный ответ — 79%, частичный ответ — 14% и отсутствие ответа на лечение — 7%.
Исследование эффективности комбинирования химиотерапии с RTHT у пациентов с неоперабельным рецидивирующим раком молочной железы: Химиотерапию и гипертермию пациенты получали один раз в неделю, через 30 мин после облучения. Кожная реакция была приемлемой, но тройная модальность вызвала значительную системную токсичность. Хотя частота ответа на терапию была высокой, местный контроль поддерживался лишь в течение нескольких месяцев.
Исследования для локально рекуррентного рака молочной железы : В этом случае локальный контроль достигается в зависимости от многих параметров комбинированного лечения, включая опухолевый ответ на RTHT. 39 женщин с рецидивами рака груди получили РТНТ, при этом гипертермия проводилась перед лучевой терапией. 1-летняя выживаемость составила 71%, а выживаемость через 2 года составила 54%. В 2001 году был опубликован опыт Медицинской школы Афинского Университета, в котором применялась комбинированная терапия RTHT для лечения поверхностных опухолей. В это исследование были включены 88 пациентов с раком молочной железы с рецидивами после мастэктомии, и 27 пациентов с рецидивирующими надключичными лимфатическими узлами. Полная частота ответов на лечение составила 85,2 и 70,4% соответственно. Одна и та же команда ученых спустя 1 год опубликовала первое исследование об эффективности липосомального доксорубицина в сочетании с RTHT. Было зарегистрировано 15 женщин-пациентов, которые страдали от локально распространенного рецидивирующего рака молочной железы. Все пациенты ответили на терапии. Полная частота ответа составляла 20%, а доля частичного ответа — 80%. Бен-Йосеф и другие ученые признали преимущества гипертермии при добавлении к лучевой терапии и описали свой опыт применения RTHT для лечения локально рецидивирующего рака молочной железы. 15 женщин получили лучевую терапию в сочетании с 45 минутами гипертермии (при 45 0C). 6 из 15 пациентов полностью ответили на терапию, 4 пациента ответили частично, а 3 пациента не ответили на терапию.
Применение RTHT у пациентов с локально-рецидивирующим карциномой молочной железы: 41 поражение из 75 было подвержено облучению ранее. Было доказано, что гипертермия в сочетании с лучевой терапией имеет более выраженный клинический эффект. Изъязвление кожи отмечалось у 14% пациентов.
Применении к локально развитому или рецидивирующему раку молочной железы с маргинальной резекцией (краевое иссечение) : В этом исследовании 15 пациентов были разделены на 2 группы. Первая группа получала RTHT после резекции в качестве первичной терапии, а вторая группа состояла из пациентов с рецидивирующими опухолями, которые также подвергались такой же процедуре лечения — гипертермии в сочетании с лучевой терапией.Общая выживаемость составила 90% для первой группы и 89% для второй группы, местные контрольные показатели были соответственно 75 и 81%, в то время как безрецидивная выживаемость составила 64 и 69% соответственно. Что касается всех пациентов, то показатели выживаемости, местного контроля и безрецидивной выживаемости составили 89, 80 и 68% соответственно.
Опыт применения гипертермии в сочетании с лучевой терапией для поверхностных рецидивов опухоли: В этом исследовании эффективность RTHT оценивалась у пациентов с рецидивом заболевания, ранее получавших облучение. После 18-месячного наблюдения местный контрольный показатель составил 72,7%, стабилизирование заболевания 20,5%, а не контрольная — 6,8%.
Эффективность повторного облучения в сочетании с гипертермией – исследование 2010 года: 78 пациентов с рецидивами рака молочной железы ответили на комбинированную терапию. 3-летний контрольный показатель составил 78%, а 5-летний контрольный показатель — 65%. 3-и 5-летняя выживаемость пациентов составила 66 и 49% соответственно.Был рассмотрен случай 66-летней женщины с рецидивирующим раком молочной железы, которая получила лучевую терапию и химиотерапию, но не ответила на лечение. Однако, когда к терапии была добавлена гипертермия, пациентка полностью ответила на лечение.Наконец, комбинированное лечение RTHT может дать хороший результат без серьезной токсичности. RTHT применялся у 198 пациентов, страдающих рецидивами рака молочной железы. 3-летний контрольный показатель составил 83%, а 5-летний контрольный показатель составил 78%.
Результаты и вывод

Результаты показывают, что использование гипертермии в комплексе с лучевой терапии и / или химиотерапией для лечения рака молочной железы увеличивает эффективность лечения.
Применение гипертермии в сочетании с другими терапевтическими методами является перспективным направлением в лечении рецидивирующего рака молочной железы. Зарегистрированные показатели ответа на терапию высоки, и сравнение лучевой терапии с добавлением гипертермии или без нее в качестве варианта лечения показывает, что гипертермия дает преимущество с точки зрения более высоких показателей ответа, местных контрольных показателей и показателей выживаемости при комбинированном лечении. Необходимо провести дополнительные исследования, чтобы оценить роль гипертермии в лечении первичных опухолей молочной железы, поскольку доступные в настоящее время результаты обнадеживают. Наконец, принимая во внимание удовлетворительные результаты многочисленных исследований по применению гипертермии в лечении рака головы и шеи и в лечении злокачественной меланомы, следует рассмотреть вопрос об интеграции гипертермии в клиническое лечение других видов поверхностных поражений. Помимо включения гипертермии в недавние рекомендации NCCN для лечения рецидивов рака молочной железы, мы предлагаем использовать RTHT для лечения других кожных новообразований и первичных поражений при раке молочной железы.
Терапевтическая гипертермия является типом лечения, при котором живые ткани подвергаются воздействию повышенной температуры. И это оказывает губительный эффект на раковые клетки, вызывающий их уничтожение, или снижает устойчивость этих клеток к воздействию радиоактивного лечения или препаратов химиотерапии. Стоит отметить, что температурное воздействие на атипичные ткани не относится к группе радиочастотной абляции, это совершенно иная методика. В сочетании с лучевой терапией метод теплового воздействия носит называние терморадиотерапия.
Гипертермия в онкологии: что это такое?
Международная онкология не выработала до сих пор общего мнения относительно того, какие показатели температуры являются самыми безопасными и одновременно самыми эффективными. Во время лечения температура тела, как правило, достигает уровня между 39,5 и 40,5 ° C. Тем не менее, другие исследователи определяют границы гипертермии между 41.8-42 ° C, что присуще для стран Европы и США. Япония и Россия принимают самые высокие показатели — 43-44 ° С.
Температура и время воздействия взаимосвязаны. Более длительная продолжительность и высокие температуры очень эффективны для уничтожения раковых клеток, но они также достаточно серьезно повышают риск токсичности. Опухолевые клетки с дезорганизованной и компактной сосудистой структурой очень тяжело отводят тепло, что способствует стимуляции апоптоза (вид физиологически запрограммированной гибели клеток) в их отношении или обычной гибели. Тогда как здоровые ткани обладают лучшей теплопроводностью, в связи с чем лучше противостоят высоким температурам.

Даже если раковые клетки не гибнут сразу, они могут стать более восприимчивы к ионизирующему излучению в противораковой терапии или химиотерапии. Тепло при локальной гипертермии расширяет кровеносные сосуды опухоли, способствуя повышению оксигенации (насыщению кислородом) новообразования, тем самым делая лучевую противораковую терапию более эффективной. Кислород является мощным радиосенсибилизатором, что значительно повышает эффективность заданной дозы излучения путем формирования ДНК-повреждений. Опухолевые клетки при недостатке кислорода могут быть в 2-3 раза более устойчивы к радиационному повреждению, чем в нормальной кислородной среде.
Гипертермия, как было доказано, весьма эффективна в сочетании с химиотерапией. Опубликованные исследования показали улучшение 10-летней выживаемости без рецидивов и метастазов у пациентов, страдавших раком мочевого пузыря, которые получали комбинированное лечение гипертермией и химиотерапией. 53 % пациентов прожили 10 последующих лет, в то время как химиотерапия в единственном варианте обеспечила выживаемость только у 15 % заболевших.
Интенсивный нагрев вызывает денатурацию и коагуляцию клеточных белков, что быстро уничтожает клетки опухоли. Более длительный умеренный нагрев до температуры всего в несколько градусов выше нормы может вызвать более тонкие структурные изменения в клетках. Мягкая термообработка в сочетании с другими способами может привести к гибели клеток по причине стимуляции биологического разрушения.
Из минусов специалисты отмечают многие биохимические последствия теплового шока в нормальных клетках, в том числе замедление роста и повышенной чувствительности к последующей ионизирующей радиоактивной терапии.
Гипертермия увеличивает приток крови к нагретой области, что может провоцировать удвоение кровотока в опухолях. Такой феномен повышает положительное воздействие химиотерапевтических средств в патологических областях.
Мягкая гипертермия, которая обеспечивает температуру, равную естественно высокой при многих инфекционных заболеваниях, может стимулировать естественные иммунологические атаки на опухоли. Однако это также индуцирует естественный физиологический ответ под названием термотолерантность, который имеет тенденцию защищать атипичные клетки.
Очень высокие температуры, выше 50 ° C, используются для абляции — прямого уничтожения некоторых опухолей. Методика использует вставки в виде металлической трубки непосредственно в опухоль, наконечник которой нагревается, это и вызывает гибель клеток по его периметру.
Стоит подчеркнуть, что методика гипертермической абляции в России пока что в стадии изучения, и в практической медицине применяется редко. Однако эффективность испытаний прогнозирует весьма неплохие перспективы этого метода, в том числе и в нашей стране.
Отличия и особенности методов локальной, регионарной и общей гипертермии
Методы терапевтической гипертермии применяются, как правило, в трех вариантах, в зависимости от показаний и лечебных возможностей.
- Локальная гипертермия
Нагревается очень маленькая площадь, как правило, в рамках самой опухоли. В некоторых случаях цель метода заключается в гибели атипичных клеток путем нагревания, не повреждая окружающие ткани. Тепло может быть стимулировано с помощью:
- ультракоротких волн;
- высоких радиочастот;
- ультразвуковой энергии;
- с использованием магнитной гипертермии.
В зависимости от локализации опухоли, тепло может быть применено к поверхности тела, внутри тканей или глубжележащих областей за счет использования игл или зондов. Одним из относительно распространенных типов является радиочастотная абляция небольших опухолей. Терапевтической цели легче всего достичь, когда опухоль находится на поверхности тела (поверхностная гипертермия) , или если существует возможность ввода игл или зондов непосредственно в опухоль (интерстициальная гипертермия).

Нагревается большая площадь тела, например, целый орган или конечность . Как правило, цель метода состоит в ослаблении раковых клеток таким образом, чтобы достичь их гибели последующим радиоактивным излучением или действием химиотерапевтических препаратов. Как и в предыдущем методе, регионарная гипертермия может использовать те же поверхностные или интерстициальные методы или опираться на перфузию крови. Во время процесса перфузии кровь пациента удаляется из организма, нагревается и возвращается в кровеносные сосуды, которые ведут непосредственно в нужную часть тела. Как правило, химиотерапевтические препараты применяются одновременно.
Одним из специализированных типов такого подхода является непрерывная перитонеальная перфузия, которая используется для лечения сложных новообразований внутри брюшной полости, в том числе первичной мезотелиомы брюшной полости и рака желудка. Горячие химиотерапевтические препараты закачивают непосредственно в брюшную полость, чтобы убить раковые клетки.
Нагревается весь организм до температуры от 39 до 43 °С и выше.
Метод, как правило, используется для лечения метастатического рака. Включает в себя использование инфракрасных гипертермических куполов, под которые помещается все тело пациента, за исключением головы. К другим способам можно отнести помещение пациента в очень горячую камеру или укутывание в нагретые влажные одеяла. Из редких методов используют специальные гидрокостюмы с постоянным подогревом или погружение в горячий воск.
Для каких видов рака может применяться гипертермия?
В одиночку гипертермия продемонстрировала уникальную способность терапии злокачественных новообразований. Также известно, что методика значительно увеличивает эффективность других методов лечения.

В сочетании с радиоактивным излучением гипертермия особенно эффективна в присутствии большого количества кислорода при условии одновременного воздействия не менее, чем в течение часа.
В последние десять лет гипертермия в сочетании с облучением была использована с лечебной целью у больных со следующими диагнозами:
- ранняя стадия рака молочной железы;
- при локализации рака на голове и шее;
Известные научные издания свидетельствуют об улучшении у 38 % пациентов при раке мочевого пузыря в сочетании с химиотерапией, по сравнению с применением только химиотерапии. У больных раком молочной железы результат показал улучшенную реакцию у 18 % пациентов.
Какие существуют еще типы рака, которые показывают значительное улучшение при лечении гипертермией?
- Меланома и рак кожи.
- Саркома мягких тканей.
- Рак мочевого пузыря.
- Рак прямой кишки.
- Злокачественные опухоли подмышечной области и грудной стенки.
- Метастазы в лимфоузлах.
Исследования в России показали интересные результаты с высокой гипертермией в 43,5-44°C, когда метод применяли в отношении:
- рака пищевода;
- рака гортани;
- рака печени;
- при ВИЧ-инфекции и расстройствах иммунной системы.
Абляция опухолей — одна из разновидностей гипертермии
Радиочастотная абляция (РЧА), вероятно, наиболее часто используемая разновидность локальной гипертермии. Для повышения температуры применяются радиоволны высокой частоты.

- Тонкий игольчатый зонд вводится в опухоль на короткое время, как правило, от 10 до 30 минут .
- Размещение зонда регулируется с помощью ультразвука, МРТ или КТ.
- Наконечник зонда выдает высокочастотный ток, который способен создать тепло между 40 и 60°С , что вызывает гибель клеток в пределах определенной области.
- Мертвые клетки не удаляются, становятся рубцовой тканью и рассасываются с течением времени.

РЧА наиболее часто используется для лечения опухолей, которые не могут быть удалены хирургическим способом, или у пациентов, которые по разным причинам не операбельны. Процедура может быть выполнена амбулаторно. Повторения абляции возможно для опухолей, способных к рецидивам. Также РЧА может быть добавлена к другим лечебным мероприятиям, в том числе оперативному удалению новообразования, лучевой терапии, химиотерапии, инфузионной терапии, алкогольной абляции или химиоэмболизации.
РЧА может быть использована для лечения опухолей, достигших в диаметре вплоть до 5 см.
Методика наиболее эффективна для лечения образований в печени, почках и легких. В настоящее время изучается ее применение в других областях тела. Долгосрочная эффективность после лечения гипертермической абляцией пока не известна, но первые результаты обнадеживают.